
本制品是一种基于磁珠法的高效便捷的基因组DNA抽提试剂盒。本制品可以用于抽提动物组织、鼠尾、培养细胞、细菌、酵母、动物血液、昆虫以及固定组织的包括基因组DNA在内的总DNA,也可以用于长度大于100bp DNA片段的抽提。本试剂盒通过说明书中提供的不同操作方法,可以抽提除植物样品外的几乎所有样品中的总DNA。
本试剂盒纯化得到的基因组DNA的长度最长可达50kb左右,平均为30kb左右,最短为100bp的DNA也可以被纯化。如需获得更长的基因组DNA,对于哺乳动物样品,包括组织或细胞等,可以使用动物基因组DNA抽提试剂盒。
按照本试剂盒的标准操作步骤抽提得到的总DNA会含有少量的RNA,但如果按照可选步骤加入适量的DNase-free的RNase A,就可以获得不含RNA的高纯度总DNA。含有RNA的总DNA可以用于PCR,但对于某些其它的后续反应可能会产生一些影响。
本试剂盒中的BalbMag磁珠,每20μL磁珠悬液对于DNA的最大结合容量约为30μg。通常每200万HeLa细胞或500万淋巴细胞可以抽提得到15~25μg总DNA,每25mg肝、脑、肾组织可以抽提得到10~30μg总DNA,每25mg心、肺组织可以抽提得到5~10μg总DNA,每10mg脾组织可以抽提得到5~30μg总DNA,每1.2cm小鼠尾尖或0.3cm大鼠尾尖可以获得10~25μg总DNA。

| 组分 | 规格 |
| BalbMag磁珠 | 1.1mL |
| 样品裂解液A | 10mL |
| 样品裂解液B | 11mL |
| 洗涤液Ⅰ | 21mL |
| 洗涤液Ⅱ | 16mL |
| 洗脱液 | 22mL |
| 蛋白酶K | 1.1mL |
保存:室温,有效期1年。

- BalbMag磁珠长期不使用时,可以4℃保存,4℃可以保存更长时间。蛋白酶K室温(15~25℃)存放一周,活力无明显下降。
- 洗涤液Ⅰ首次使用前加入7mL无水乙醇,洗涤液Ⅱ首次使用前加入24mL无水乙醇,混匀,并在瓶上做好标记。
- 需自备磁分离装置。
- 抽提细菌、酵母样品时还需要一些特定的试剂,详情请参考使用说明中的相关描述。
- 如需制备不含RNA的高纯度总DNA,需自备DNase free的RNase A,推荐订购RNase A(不含DNase)。
- 温度较低时样品裂解液A或样品裂解液B中可能会有沉淀产生,属正常现象。使用前必须检查一遍。如有沉淀,55℃水浴孵育使沉淀溶解,混匀后使用。
- 磁珠在静置后会发生沉降,使用前一定要适当涡旋震荡或颠倒数次至充分混匀。
- 磁分离前应适度震荡离心管使磁珠充分分散后再靠近磁场。如果出现磁珠挂壁现象,可以在磁珠聚集后晃动管内液体,使挂壁的磁珠流下。
- 请使用推荐的样品量。如果样品量过大,可能造成磁珠聚集,会影响洗涤进而影响抽提获得的DNA纯度。发生磁珠聚集时,洗涤时需尽量分散磁珠,这样可有效改善抽提效果。如果发生磁珠聚集现象,建议在后续实验中适当减少样品用量。
- 本试剂盒的某些步骤需使用55℃和70℃水浴,请提前作好准备。
- 除特别说明外,每次Vortex应控制在5~10秒左右。
- 本试剂盒所有操作均在室温进行,操作时无需冰浴。
- 参考如下使用说明,从某些样品中抽提总DNA不需要使用样品裂解液A。

本试剂盒的原理和操作流程如图1所示。样品首先被蛋白酶K消化,释放出来的基因组DNA在特定条件下与磁珠特异性结合。在外界磁场(如磁分离架)的作用下,磁珠与相应溶液可以快速高效地分离。随后通过两次洗涤去除各种杂质,最后通过洗脱液将DNA从磁珠上洗脱下来。整个过程无需酚氯仿抽提,无需酒精沉淀,样品裂解后仅需约15分钟即可完成。
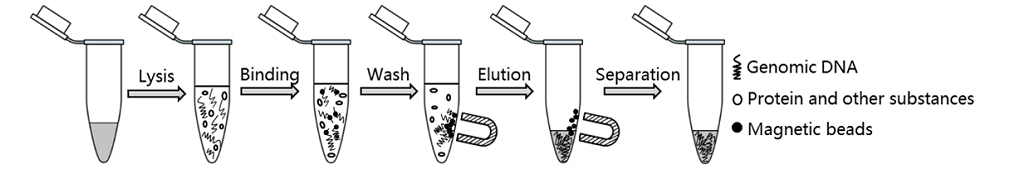
图1.磁珠法基因组DNA小量提取试剂盒操作流程示意图。

本试剂盒按照推荐的操作步骤,每次可抽提少至数百个细胞,多至25mg组织、0.5-1cm鼠尾、500万个培养细胞、20亿个细菌或5000万个酵母。样品用量过多,反而会影响抽提效果。如果待抽提样品的DNA含量小于5ng,建议加入适当量的carrier DNA,例如poly-dT或其它对后续实验没有干扰的DNA,也可以加入适当量的carrier RNA,例如酵母RNA等,以改善抽提效果。本试剂盒与柱式基因组DNA小量提取试剂盒的提取效果对比参见图2。如图2所示,本试剂盒用于提取细胞和组织样品的DNA时,提取得到的DNA的量与离心柱式试剂盒相当。
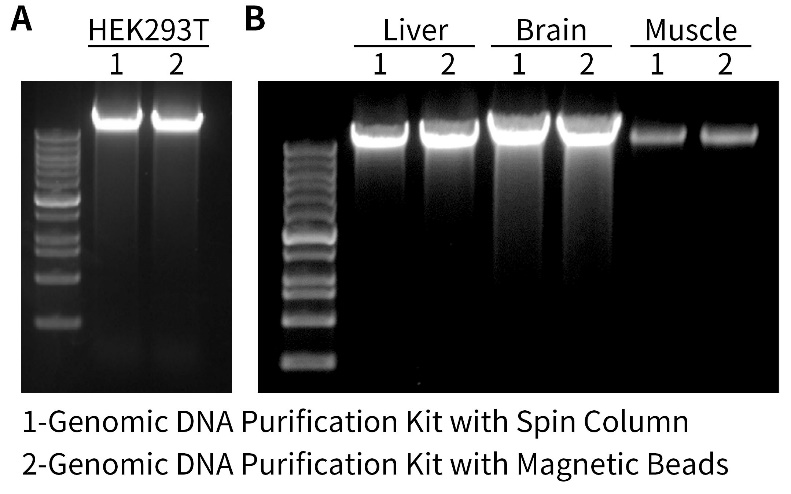
图2.磁珠法基因组DNA小量提取试剂盒和柱式基因组DNA小量提取试剂盒用于从HEK293T细胞和小鼠组织抽提基因组DNA的效果图。图A使用两款试剂盒分别抽提100万HEK293T细胞的总DNA,图B使用两款试剂盒分别抽提小鼠组织(肝脏、脑和肌肉)的总DNA,洗脱液用量均为50μL,取8μL洗脱后的样品混合1.6μL 6×DNA上样缓冲液(红色),使用0.8%琼脂糖凝胶进行电泳检测。实际结果会因实验条件、检测仪器等的不同而存在差异,图中效果仅供参考。

- 从动物组织中提取总DNA:
- 取不超过25mg的组织(脾不超过10mg),尽量在10mg左右,剪切成尽可能小的碎片,加入180μL样品裂解液A。或置于液氮中研磨成粉末,再加入180μL裂解液A。也可将组织置于1.5mL离心管中,加入180μL冰浴预冷的裂解液A,用微型电动匀浆器匀浆,或者用普通玻璃匀浆器进行匀浆。
请勿使用过多的样品,过多的样品会导致抽提效果下降。较小的组织碎片会使裂解速度加快,裂解效果提高。新鲜或冻存的组织均可,但固定过的组织请参考后续的其它步骤进行。 - 加入20μL蛋白酶K,Vortex混匀,55℃水浴孵育至完全裂解。
在孵育期间可以偶尔取出样品Vortex以加快裂解速度。裂解的时间因组织不同而有所不同,通常可在1~3小时内完成。为方便起见,可以直接裂解过夜,裂解过夜对抽提效果无任何负面影响。组织完全裂解后可以呈粘稠状,但不应该呈凝胶状。如果消化过夜仍呈凝胶状,说明样品用量过多,作为补救措施,可以把整个反应体系放大一倍。 - 清除RNA (可选做)。如果希望获得不含RNA的高纯度总DNA,加入4μL 100mg/mL RNase A,Vortex混匀。室温(15~25℃)放置2分钟。
转录活性水平很高的组织例如肝和肾组织,RNA含量很高,在不做清除RNA的操作步骤(步骤1.c)的情况下,会导致最后获得的总DNA含有小部分RNA。如果残余的少量RNA对后续实验没有干扰,可以不进行本步实验操作,直接进入步骤1.d。 - 最高速剧烈Vortex 15秒。加入200μL样品裂解液B,Vortex混匀。70℃孵育10分钟。
加入样品裂解液B后需立即Vortex混匀。加入样品裂解液B后可能会产生白色沉淀,但大多数情况在70℃孵育后会溶解。即使70℃孵育后仍有白色沉淀也不会干扰后续实验。有些组织例如肺、脾,在加入样品裂解液B后可能会形成凝胶状物,此时需剧烈晃动或Vortex样品,以尽量破坏凝胶状物。 - 加入200μL无水乙醇,Vortex混匀。
加入乙醇后必须充分混匀,否则会严重影响抽提效果。加入乙醇后可能产生白色沉淀,属正常现象,后续步骤中必须把白色沉淀和溶液全部用于和磁珠的结合,沉淀不会影响抽提效果。 - 向步骤e中的混合物加入20μL BalbMag磁珠悬液(使用前务必混匀),轻柔混匀后,室温放置3~5分钟。将离心管置于磁力架的磁场中,待磁珠完全聚集后,小心吸除残液。
磁珠在使用前一定要涡旋或震荡混匀。如有必要,可适当增加磁珠用量,延长结合时间以提高得率。 - 加入500μL洗涤液Ⅰ,轻柔震荡使磁珠分散开,颠倒2次后将离心管置于磁力架的磁场中,待磁珠完全聚集后,尽量吸净残液。
- 加入600μL洗涤液Ⅱ,轻柔震荡使磁珠分散开,颠倒2次后将离心管置于磁力架的磁场中,待磁珠完全聚集后,尽量吸净残液。
- 将离心管室温放置5~10分钟,或置于37℃鼓风烘箱5分钟,确保残留的乙醇等微量液体完全挥发。
- 加入50~100μL洗脱液,轻柔震荡使磁珠悬于溶液中,室温孵育3~5分钟,其间甩动离心管1~2次。将离心管置于磁场中,待磁珠完全聚集后,小心吸取溶液至新离心管中,置于-20℃保存。所得溶液即为纯化的总DNA。
如需获得更高浓度的样品,可把洗脱液的体积减小至20μL,但洗脱下来的DNA量会相对减少。室温较低时,洗脱液在37℃预热片刻对得率有所帮助。此外,洗脱后的溶液再次加回到原磁珠再洗脱一次,可提高得率约10~30%;或者在第一次洗脱后使用新的洗脱液再洗脱一次,会获得约为第一次洗脱量15~40%的DNA。
- 取不超过25mg的组织(脾不超过10mg),尽量在10mg左右,剪切成尽可能小的碎片,加入180μL样品裂解液A。或置于液氮中研磨成粉末,再加入180μL裂解液A。也可将组织置于1.5mL离心管中,加入180μL冰浴预冷的裂解液A,用微型电动匀浆器匀浆,或者用普通玻璃匀浆器进行匀浆。
- 从鼠尾中抽提总DNA:
- 取0.4-0.6cm的大鼠尾尖一段,或小鼠尾尖最多两段,加入180μL样品裂解液A。
小鼠尾尖最长不能超过1.2cm,大鼠尾尖不能超过0.6cm。如果使用的是成年大鼠或小鼠,建议仅使用0.4-0.6cm长的尾尖。如果抽提鼠尾的DNA用于基因型鉴定(Genotyping),使用0.2-0.3cm长的尾尖已经足够。 - 加入20μL蛋白酶K,Vortex混匀,55℃水浴孵育至完全裂解。
在孵育期间可以偶尔取出样品Vortex以加快裂解速度。并确保鼠尾浸没在裂解液内。裂解完全通常需6~8小时。为方便起见,可以直接裂解过夜,裂解过夜对抽提效果无任何负面影响。组织完全裂解后可以呈粘稠状,但不应该呈凝胶状。如果消化过夜仍呈凝胶状,说明样品用量过多,作为补救措施,可以把整个反应体系放大一倍。 - 清除RNA (可选做)。如果希望获得不含RNA的高纯度总DNA,则加入4μL 100mg/mL RNase A,Vortex混匀。室温(15~25℃)放置2分钟。
鼠尾中RNA含量很低,但在不做清除RNA的操作步骤(步骤2.c)的情况下,会导致最后获得的总DNA含有少量的RNA。如果残余的少量RNA对后续实验没有干扰,可以不进行本步实验操作,直接进入步骤2.d。 - 按照等体积混合适当体积的样品裂解液B和无水乙醇,Vortex混匀。
每一个样品,需混合200μL样品裂解液B和200μL无水乙醇。如果有10个样品,则需混合2mL样品裂解液B和2mL无水乙醇,以此类推。配制好的样品裂解液B和无水乙醇的等体积混合液,室温放置,3个月内有效。必须Vortex充分混匀,否则会严重影响抽提效果。 - 最高速剧烈Vortex 15秒。加入400μL步骤d配制的样品裂解液B和无水乙醇等体积混合液,剧烈Vortex混匀。
加入样品裂解液B和无水乙醇的等体积混合液后可能会产生白色沉淀,属正常现象,后续步骤中必须把白色沉淀和溶液全部用于和磁珠的结合,沉淀不会影响抽提效果。 - 转步骤1.f,后续步骤同“从动物组织中提取总DNA”1.f起的步骤。
- 取0.4-0.6cm的大鼠尾尖一段,或小鼠尾尖最多两段,加入180μL样品裂解液A。
- 从培养的动物细胞中抽提总DNA:
- 收集最多不超过500万的细胞,离心沉淀后重悬于200μL PBS溶液中。
PBS需自备。如果使用冻存的细胞沉淀,先把细胞沉淀解冻,并轻轻弹散,然后再加入PBS。对于基因组DNA含量较高的细胞,例如HeLa细胞,应使用较少的细胞,例如100-200万HeLa细胞。 - 清除RNA (可选做)。如果希望获得不含RNA的高纯度总DNA,加入4μL 100mg/mL RNase A,Vortex混匀。室温(15~25℃)放置2分钟。
在不做清除RNA的操作步骤(步骤3.b)的情况下,会导致最后获得的总DNA含有小部分RNA。如果残余的少量RNA对后续实验没有干扰,可以不进行本步实验操作,直接进入步骤3.c。 - 加入20μL蛋白酶K,Vortex混匀。
- 加入200μL样品裂解液B,Vortex混匀。70℃孵育10分钟。
加入样品裂解液B后必须立即Vortex混匀。不可把蛋白酶K直接和样品裂解液B混合。 - 加入200μL无水乙醇,Vortex混匀。
加入乙醇后必须充分混匀,否则会严重影响抽提效果。加入乙醇后可能会产生白色沉淀,属正常现象,后续步骤中必须把白色沉淀和溶液全部用于和磁珠的结合,沉淀不会影响抽提效果。 - 转步骤1.f,后续步骤同“从动物组织中提取总DNA”1.f起的步骤。
- 收集最多不超过500万的细胞,离心沉淀后重悬于200μL PBS溶液中。
- 从动物血液中抽提总DNA:
本操作方法也适用于血沉棕黄层(Buffy coat)和骨髓(Bone marrow)的总DNA抽提。- 取50~100μL红细胞无细胞核的血,或5~10μL红细胞有细胞核的血。
人、猴、牛、兔、大鼠、小鼠等的红细胞无细胞核,鸟、鱼、蛙等的红细胞有细胞核。红细胞有细胞核会导致相同体积的血液内DNA的含量非常高。 - 加入20μL蛋白酶K。
- 加入PBS至总体积为220μL,Vortex混匀。
- 加入200μL样品裂解液B,Vortex混匀。70℃孵育10分钟。
- 转步骤3.e,后续步骤同“从培养的动物细胞中抽提总DNA”3.e起的步骤。
- 取50~100μL红细胞无细胞核的血,或5~10μL红细胞有细胞核的血。
- 从石蜡包埋的组织样品中抽提总DNA:
由于包埋的组织通常已经被固定,通常仅能获得长度小于650bp的DNA。乙醇或甲醛固定的石蜡包埋组织样品相对比较适合DNA的抽提,而有交联作用的固定试剂(例如锇酸)固定的组织则不适合用于抽提DNA。需自备二甲苯。- 取一块小于25mg的包埋块,加入1.2mL二甲苯,剧烈Vortex,以充分脱腊。
- 台式离心机最高速(12000~14000rpm)室温离心5分钟,弃上清。
- 去除上清的时候要非常小心,不要把沉淀丢失了。
- 加入1.2mL无水乙醇,轻轻Vortex混匀,以去除残留的二甲苯。
- 台式离心机最高速(12000~14000rpm)室温离心5分钟,弃上清。
- 去除上清的时候要非常小心,不要把沉淀丢失了。
- 重复步骤c和d一次,即再用乙醇洗涤样品一次。
- 弃上清后再最高速离心1分钟,用20μL枪小心吸除残留的液体。
- 室温放置数分钟至乙醇全部挥发。
- 加入180μL样品裂解液A。
- 转步骤1.b,后续步骤同“从动物组织中提取总DNA”1.b起的步骤。
- 取一块小于25mg的包埋块,加入1.2mL二甲苯,剧烈Vortex,以充分脱腊。
- 从甲醛固定的组织中抽提总DNA:
由于组织已经被固定,通常仅能获得长度小于650bp的DNA。甲醛或乙醇固定的组织样品相对比较适合DNA的抽提,而有交联作用的固定试剂(例如锇酸)固定的组织则不适合用于抽提DNA。乙醇固定的组织可以参考甲醛固定的组织的抽提方法进行总DNA的抽提。- 取不超过25mg的组织,用PBS洗涤两次,以充分去除固定液。
- 去除PBS,转步骤1.a,后续步骤同“从动物组织中提取总DNA”1.a起的步骤。
- 取不超过25mg的组织,用PBS洗涤两次,以充分去除固定液。
- 从革兰氏阴性菌中抽提总DNA:
- 离心收集最多不超过20亿个细菌,弃上清。
- 加入180μL样品裂解液A,充分重悬细菌。
- 转步骤1.b,后续步骤同“从动物组织中提取总DNA”1.b起的步骤。
- 离心收集最多不超过20亿个细菌,弃上清。
- 从革兰氏阳性菌中抽提总DNA:
需自备溶菌酶,并配制溶菌酶溶液:20mM Tris,pH8.0,2mM EDTA,1.2% Triton X-100,20mg/mL溶菌酶。溶菌酶在临使用前加入。- 离心收集最多不超过20亿个细菌,弃上清。
- 用180μL溶菌酶溶液充分重悬细菌。
- 37℃孵育30分钟以裂解细菌。
- 加入20μL蛋白酶K,Vortex混匀。
- 加入200μL样品裂解液B,Vortex混匀。
- 不可把蛋白酶K直接加入到样品裂解液B中。
- 70℃孵育30分钟。
- 转步骤1.e,后续步骤同“从动物组织中提取总DNA”1.e起的步骤。
- 离心收集最多不超过20亿个细菌,弃上清。
- 从酵母中抽提总DNA:
需自备用于裂解酵母的酶Lyticase,并配制酵母裂解液:1M山梨糖醇(Sorbitol),100mM EDTA,14mM 2-巯基乙醇。- 离心收集最多不超过50万个酵母,弃上清。
- 用600μL上述酵母裂解液重悬,加入200U Lyticase,30℃孵育30分钟。
- 裂解的时间会随酵母的种类不同而有所不同,详细情况请参考Lyticase的说明书。
- 300×g离心10分钟收集沉淀,弃上清。
- 沉淀用180μL样品裂解液A重悬。
- 转步骤1.b,后续步骤同“从动物组织中提取总DNA”1.b起的步骤。
- 离心收集最多不超过50万个酵母,弃上清。
- 从昆虫中抽提总DNA:
- 用液氮冷冻后研碎处理:
① 取最多不超过50mg昆虫(例如果蝇),液氮冷冻后研碎,转移至1.5mL离心管中。
② 加入180μL样品裂解液A。
③ 转步骤1.b,后续步骤同“从动物组织中提取总DNA”1.b起的步骤。 - 用匀浆器匀浆处理:
①取最多不超过50mg昆虫(例如果蝇)。
② 加入180μL PBS,用电动匀浆器或玻璃匀浆器匀浆。
③ 转步骤3.b,后续步骤同“从培养的动物细胞中抽提总DNA”3.b起的步骤。
- 用液氮冷冻后研碎处理:
- 从其它样品中抽提总DNA:
对于某些样品需使用特定的裂解液裂解,可以参考如下方法进行总DNA的抽提。- 样品用200μL特定的裂解液裂解。裂解需确保呈溶液状态,如果有不溶物需通过离心沉淀去除。
- 加入20μL蛋白酶K。
- 加入200μL样品裂解液B,立即Vortex混匀。70℃孵育10分钟。
- 检查整个溶液的pH值,确保pH值小于7.0,否则DNA结合到磁珠的效率会很低。
- 转步骤1.e,后续步骤同“从动物组织中提取总DNA”1.e起的步骤。
- 样品用200μL特定的裂解液裂解。裂解需确保呈溶液状态,如果有不溶物需通过离心沉淀去除。
相关搜索:磁珠法基因组DNA小量提取试剂盒,基因组DNA提取,动物组织DNA提取,鼠尾DNA提取,培养细胞DNA提取,细菌DNA提取,酵母DNA提取,血液DNA提取,昆虫DNA提取,固定组织DNA提取,通用型DNA提取



